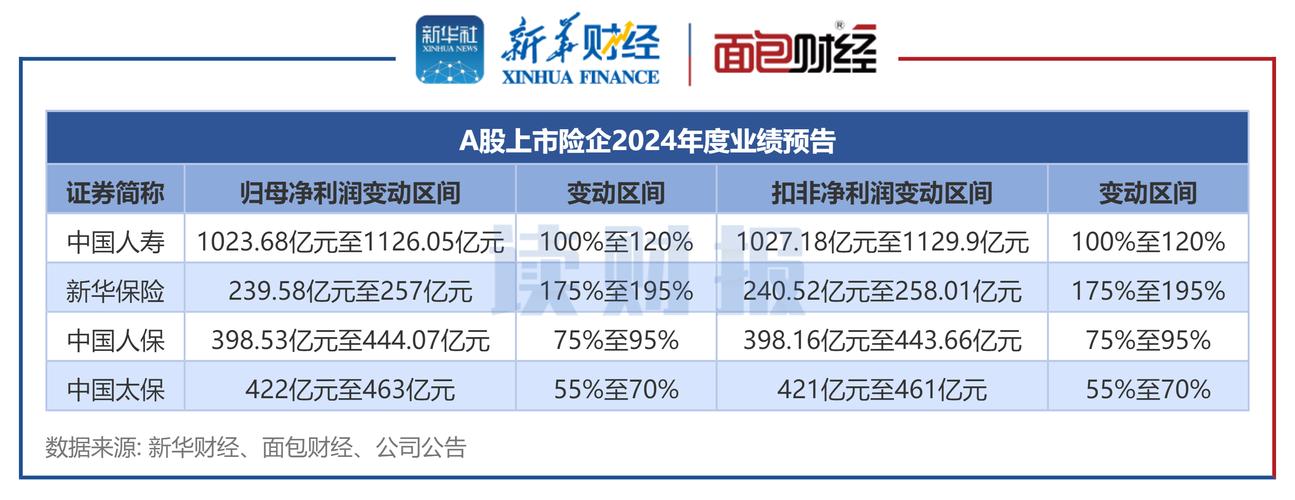
联拓生物发布2021年第四季度和全年财务业绩并宣布公司近期动态
每日财经(Mrcj88.cn)讯:
Mavacamten用于治疗中国有症状的梗阻性肥厚型心肌病患者的3期注册试验正在进行
用于治疗梗阻性肥厚型心肌病的mavacamten在中国获得突破性治疗药物认证

英菲格拉替尼在海南博鳌先行区获批用于治疗胆管癌患者
三个其他产品管线项目预计将在2022年底前在中国启动3期注册临床试验
4.032亿美元现金储备足以维持至2023年的营业需求
中国上海和美国普林斯顿, March 31, 2022 (GLOBE NEWSWIRE) -- 联拓生物(纳斯达克股票代码:LIAN),一家专注于为中国和亚洲主要市场的患者带来创新性药物的生物科技公司,今日发布公司截至2021年12月31日的第四季度和全年财务业绩。
对于过去一年所取得的进展,我们深感自豪,特别是达成了一系列关键的临床和公司里程碑,包括启动mavacamten在用于治疗中国有症状的梗阻性肥厚型心肌病患者的3期临床试验EXPLORER-CN,以及海南省批准英菲格拉替尼用于治疗胆管癌患者。联拓生物首席执行官王轶喆博士表示,联拓生物将继续推进对产品管线中已获得临床验证的药品的开发。同时,我们也计划于年底前在中国启动涉及TP-03、NBTXR3和英菲格拉替尼的额外三项关键性研究。联拓生物将持续专注于公司的跨境发展战略,并致力于为大中华区和其他亚洲市场患者不断建立创新药物的产品管线。
近期业务亮点及临床发展动态:
启动mavacamten在用于治疗有症状的梗阻性肥厚型心肌病的3期临床试验EXPLORER-CN并完成了药代动力学试验的给药。
2021年11月,联拓生物启动并完成了对中国健康志愿者药代动力学研究的招募和给药。
2022年1月,联拓生物启动了mavacamten在用于治疗中国有症状的梗阻性肥厚型心肌病患者的3期临床试验EXPLORER-CN。
2022年2月,联拓生物合作伙伴百时美施贵宝(BMS)宣布mavacamten的一项3期临床试验VALOR-HCM获得积极的顶线结果,该试验用于评估mavacamten在治疗符合室间隔缩小治疗条件的梗阻性肥厚型心肌病患者中的疗效。
2022年2月,联拓生物宣布用于治疗梗阻性肥厚型心肌病的mavacamten在中国获得国家药品监督管理局药品审评中心授予的突破性治疗药物认证。
英菲格拉替尼在海南博鳌先行区获批用于治疗胆管癌患者
2021年12月,英菲格拉替尼获得海南省卫生和健康委员会及海南省药品监督管理局批准,用于治疗携带FGFR2基因融合或重排且既往接受过治疗的、不可切除的局部晚期或转移性胆管癌患者。此次中国的获批是基于该药在全球其他地区的批准,并推动了英菲格拉替尼在海南博鳌乐城国际医疗旅游先行区实现了早期商业化。
招募关键员工,壮大联拓生物领导团队,并任命两名新董事会成员
2021年10月,联拓生物任命Michael Humphries博士担任公司首席科学顾问,负责指导公司的研发战略,推进管线产品开发,并领导对新药引入许可机会的科学性评估。
2021年10月,联拓生物任命吴人伟先生和Susan Silbermann女士担任公司董事会成员。
完成首次公开发行募资总额达3.345亿美元
2021年11月,联拓生物通过首次公开发行和IPO后承销商行使的美国存托股份(ADS)超额配售权,募资所得款项总额为3.345亿美元,所得款项净额为3.048亿美元。
2022年预计关键里程碑事件:
Mavacamten
与百时美施贵宝(BMS)合作的心肌肌球蛋白抑制剂,用于治疗肥厚型心肌病和特定形式的心力衰竭
针对向美国食品药品监督管理局(FDA)提出的用于治疗梗阻性肥厚型心肌病患者的mavacamten新药申请,联拓生物的合作伙伴BMS已宣布《处方药申报者付费法案》(PDUFA)的目标日期为2022年4月28日。
TP-03
与Tarsus Pharmaceuticals合作的y-氨基丁酸门控氯通道(GABA-Cl)拮抗剂,用于治疗蠕形螨睑缘炎和睑板腺功能障碍
联拓生物预计于2022年下半年启动TP-03在中国蠕形螨睑缘炎患者中的3期试验,以支持中国的监管审批。
联拓生物的合作伙伴Tarsus宣布,该公司预计于2022年4月披露TP-03在蠕形螨睑缘炎患者中进行的3期Saturn-2试验的顶线数据。
NBTXR3
与Nanobiotix合作的放射增敏剂,用于治疗多种实体瘤适应症
联拓生物预计于2022年下半年在Nanobiotix正在进行的NBTXR3全球关键性3期试验中开始对中国患者进行给药,用于治疗不适用顺铂的局部晚期头颈部鳞状细胞癌老年患者。
英菲格拉替尼
与QED合作的FGFR1-3选择性抑制剂,用于治疗伴有FGFR驱动基因的肿瘤患者
联拓生物预计于2022年下半年在正进行的英菲格拉替尼全球关键性3期试验(PROOF-301)中开始对中国患者进行给药,用于一线治疗伴有FGFR2基因融合或重排的胆管癌患者。
2021年第四季度及全年财务业绩:
研发费用
研发费用:2021年第四季度研发费用为765万美元,2020年同期研发费用为271万美元。2021年全年研发费用为1.587亿美元,2020年同期研发费用为1.209亿美元。研发费用的增加主要由于里程碑付款的增长,以及支持临床试验而进行的开发活动和人事相关费用的提升。
一般及行政管理费用
一般及行政管理费用:2021年第四季度一般及行政管理费用为1,438万美元,2020年同期为649万美元。2021年全年一般及行政管理费用为3,689万美元,2020年同期为1,398万美元。一般及行政管理费用的增加主要由于员工人数增加造成工资和人事相关费用(包括股权激励费用)的增长,以及法律、咨询和会计服务费的增长。
净亏损
净亏损:2021年第四季度净亏损为2,120万美元,2020年同期为净亏损1,274美元。2021年全年净亏损为1.963亿美元,2020年同期为净亏损1.396亿美元。
现金储备
现金储备:截至2021年12月31日,现金、现金等价物、有价证券及受限资金为4.032亿美元,较截至2020年12月31日的现金储备净增长1.489亿美元。联拓生物预计当期现金储备将足以维持公司至2023年的营业需求。
关于联拓生物
联拓生物(LianBio)是一家跨国生物技术公司,其使命是为中国和亚洲患者带来颠覆性药物,改变长期以来本地区缺少创新药物的状况。通过与全球高度创新的生物制药公司合作,联拓生物正在推进其多样化的临床候选药物产品管线,有可能推动心血管、肿瘤、眼科、炎症疾病和呼吸系统不同适应症的新治疗标准。联拓生物正在建立国际化的基础设施,从而将公司定位为首选的合作对象,并为合作伙伴提供进入中国和其他亚洲市场的平台。
关于前瞻性陈述的警示说明
本新闻稿包含对未来预期、计划和前景的陈述及其他并非对历史事实的陈述,这些陈述可能构成前瞻性陈述。这些前瞻性陈述或以预期、相信、继续、可以、估计、期待、打算、或许、计划、潜在、预计、预测、将会、目标、将、将要等措辞或其他类似表达来识别,但并非所有的前瞻性陈述都含有该等识别性措辞。本新闻稿中的前瞻性陈述包括但不限于,公司就以下事项的计划和期望的陈述:有关公司临床试验的启动和完成、候选治疗药物管线的进展、向亚洲患者提供颠覆性药物的能力,新药引入许可机会的可用性,预计能够为其运营费用和资本支出需求而提供资金的时间表,以及有关公司合作伙伴宣布的计划和对其计划产品开发活动、临床前研究和临床试验预期的声明。未来的实际情况与前瞻性陈述所预期的事项出现重大差异可能源于各种重要因素,包括:公司能否成功启动和进行其计划内的临床试验、按照预期时间表完成此类临床试验并获得结果的能力;公司计划利用其合作伙伴的全球注册试验和临床开发计划中所产生的数据,以获得监管部门的批准,并最大限度地扩大其候选产品的患者范围;公司能否识别新候选药物并成功从第三方获得此类候选药物的能力;来自其他生物技术和制药公司的竞争;一般市场情况;在联拓生物于2021年10月31日首次公开发行时向美国证券交易委员会(SEC)提交的最终招股说明书以及随后提交的文件中,所描述的法律法规变化的影响以及相关风险和不确定性。本新闻稿中所包含的前瞻性陈述系截至本新闻稿发布之日,联拓生物特此声明无论是否出现了新的信息、未来事件或其它情况,其无责任更新任何前瞻性陈述。在本新闻稿发布日之后,务请阁下不应依赖本新闻稿中的信息,或将该等信息视为最新或准确。
投资方联系人:
IR@lianbio.com
媒体联系人:
katherine.smith@canalecomm.com